医学部药学院李国锋/王锐教授团队在PLOS BIOLOGY发表靶向蛋白质降解领域新发现
2024年5月20日,深圳大学医学部药学院李国锋助理教授、王锐教授、南方科技大学田瑞琳助理教授、中山大学洪亮教授等合作在PLOS BIOL.(IF = 9.8)上发表题为“Alkenyl oxindole is a novel PROTAC moiety that recruits the CRL4DCAF11 E3 ubiquitin ligase complex for targeted protein degradation”的研究论文,该研究报道了烯基氧化吲哚作为蛋白靶向嵌合体(PROTAC)的关键组成部分,可有效招募CRL4DCAF11 E3泛素连接酶复合体,进而促进特定蛋白的靶向降解,为药物研发提供了一种新的策略。深圳大学医学部博士生王颖、南方科技大学博士后魏天资和深圳大学博士后赵漫为共同第一作者。

靶向蛋白质降解(TPD)已成为一种有价值的药物发现策略。与传统的抑制蛋白质功能的药物不同,TPD药物利用细胞内固有的降解途径,有选择地降解特定目标蛋白,发挥治疗作用。这一革命性的药物开发策略不仅开辟了靶向药物研发的新模式,也为传统策略无法破解的难题提供了潜在的解决方案。
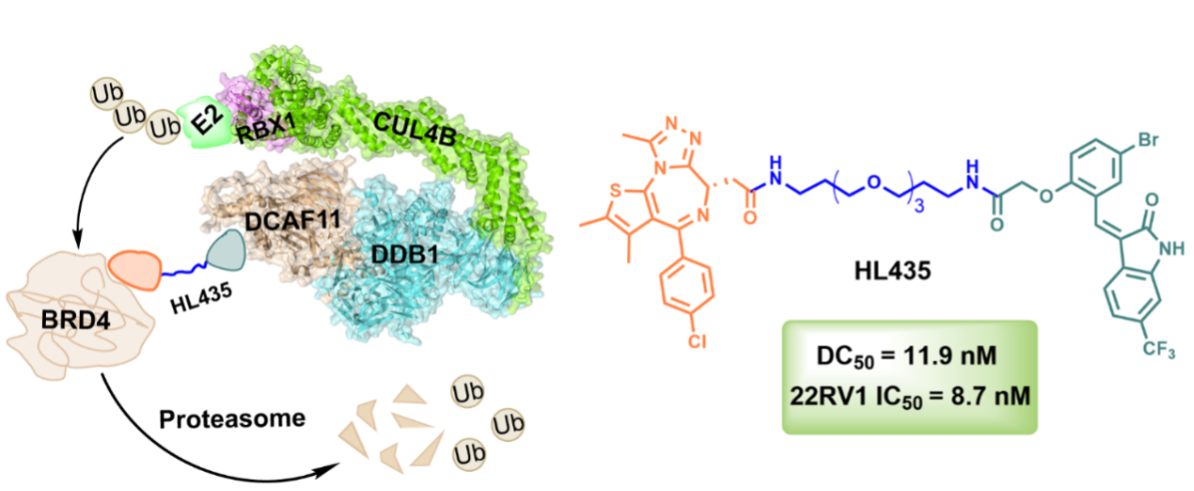
该研究团队利用之前报道的自噬分子胶烯基氧化吲哚与BRD4配体(+)-JQ-1,通过连接子偶联,合成了一系列嵌合体化合物,并探索了这些化合物对BRD4的降解效率和抗肿瘤活性。其中,先导化合物HL435在体外实验中展示出超过99%的BRD4降解效率,其在MDA-MB-231细胞中的DC50为11.9 nM。此外,HL435的BRD4降解活性与其抗增殖活性高度一致,尤其在抑制前列腺癌细胞株22RV1的增殖方面表现出色,其IC50为8.7 nM。
在验证靶蛋白降解机制的过程中,研究团队意外地发现,以自噬分子胶烯基氧化吲哚为基础构建的嵌合体先导化合物HL435,并非通过自噬-溶酶体途径实现的BRD4蛋白的降解,而是依赖于泛素-蛋白酶体系统。这一发现提示烯基氧化吲哚可能具有招募泛素-蛋白酶体系统相关酶的潜力。
为了深入理解HL435招募泛素-蛋白酶体系统相关酶的机制,该研究团队进行了CRISPR干扰技术(CRISPRi)筛选研究。研究结果表明,E3泛素连接酶CRL4DCAF11复合体在HL435诱导BRD4蛋白通过泛素-蛋白酶体系统进行降解的过程中扮演了至关重要的角色。
此外,该研究团队还对先导化合物HL435在乳腺癌治疗中的效果进行了全面评估,结果显示,HL435不仅能显著阻滞乳腺癌细胞周期进程、诱导细胞凋亡等,还能在动物模型中有效抑制移植瘤生长。这一成果不仅证实了烯基氧化吲哚结构在蛋白降解中的应用潜力,还有望为靶向蛋白质降解药物的研发和应用提供有价值的借鉴。
该研究得到了国家自然科学基金委等项目的支持。
原文连接:https://doi.org/10.1371/journal.pbio.3002550
作者:李国锋; 校稿:程永现; 发布:李振驰

用户登录
还没有账号?
立即注册