医学部朱卫国教授团队在Nucleic Acids Research期刊发表突破性论文
近日,深圳大学医学部朱卫国教授团队在国际知名期刊Nucleic Acids Research (核酸研究)上在线以突破性文章(Breakthrough article)发表了题为“GLP-catalyzed H4K16me1 promotes 53BP1 recruitment to permit DNA damage repair and cell survival”(doi: 10.1093/nar/gkz897)的文章。该研究首次阐述了组蛋白H4新位点的甲基化修饰在DNA损伤修复中的重要作用。该研究提出组蛋白甲基转移酶GLP在DNA损伤应答过程中催化H4赖氨酸16位单甲基化,促进DNA损伤修复中重要蛋白53BP1的招募和非同源末端连接修复。该研究丰富了组蛋白修饰调控DNA损伤修复的内容,为肿瘤治疗提供了新的思路。
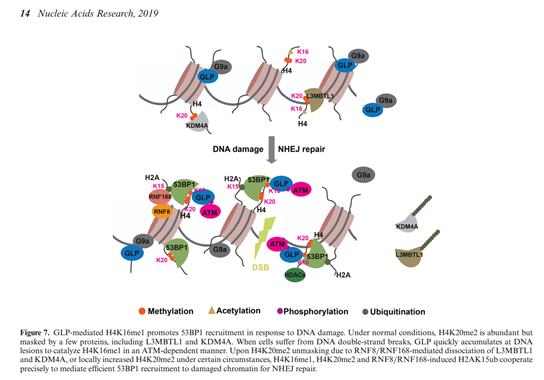
组蛋白是细胞染色质的重要组成成分。组蛋白包含核心组蛋白H2A,H2B,H3和H4,以及连接组蛋白H1。组蛋白修饰是经典表观遗传学的一个重要组成部分,它在细胞的生命过程中发挥着重要的生物学功能调控作用。作为和核心组蛋白之一,组蛋白H4修饰可以调控例如基因表达、染色质结构、DNA损伤修复应答等一系列生物学过程。在之前的研究中,组蛋白H4赖氨酸16位的乙酰化(H4K16ac)和赖氨酸20位的二甲基化(H4K20me2)都被报道是参与DNA损伤修复的重要组蛋白修饰。在DNA损伤修复重要蛋白53BP1的招募中,H4K16ac可以抑制H4K20me2对53BP1的招募,在DNA修复通路选择中发挥重要作用。最近研究表明H4K16ac在DNA损伤修复中动态变化,提示H4K16位点有可能有新的修饰种类在DNA损伤修复中发挥作用。
该研究针对H4K16位点是否有甲基化修饰参与DNA损伤修复展开研究。通过开发H4K16特异性甲基化抗体,利用电离辐射和DNA损伤诱导药物鉴定出参与DNA损伤修复的新修饰H4K16单甲基化(H4K16me1)。进一步的,该团队通过利用分子生物学和细胞生物学研究方法,鉴定出了体内体外可以催化H4K16me1的组蛋白甲基转移酶GLP。DNA损伤应答中,GLP被快速招募到DNA损伤位点,催化组蛋白H4K16me1。研究表明GLP和H4K16me1对DNA修复重要蛋白53BP1的招募起重要作用。和H4K16ac功能相反,H4K16me1可以和H4K20me2协同作用,共同促进53BP1的招募。此外,该研究还发现了组蛋白甲基转移酶GLP独立于和G9a的招募,以及发现重要蛋白激酶ATM参与了DNA损伤修复中GLP的招募和H4K16me1的建立。
本文通讯作者朱卫国教授是深圳大学医学部特聘教授。该论文主要由朱卫国教授课题组博后陆小鹏和毕业博士生汤明完成,二人并列第一作者。该研究依托深圳大学医学部和北京大学医学部的研究平台,获得了国家重点研发计划、国家基金委、广东省重点实验室和深圳市科创委、发改委的资助。


用户登录
还没有账号?
立即注册