医学部刘宝华特聘教授团队在Nature metabolism期刊发表研究论文
近日,深圳大学医学部刘宝华特聘教授团队在《Nature metabolism》上发表了题为“SIRT7 couples light-driven body temperature cues to hepatic circadian phase coherence and gluconeogenesis”(DOI: https://doi.org/10.1038/s42255-019-0136-6)的文章。刘宝华教授为通讯作者,刘佐君助理教授和钱民先副教授为共同第一作者。
人体的昼夜节律系统包括中央节律钟(central pacemaker)和外周节律钟(peripheral clocks)。中央节律钟位于下丘脑的视交叉神经上核(suprachiasmatic nuclei,SCN)),其通过接收光信号进而调控生理和行为的昼夜节律。外周节律钟存在于几乎所有的外周组织以及细胞中,其主要受到进食行为的影响。人体的昼夜节律系统需要时刻维持着同步化,即相位的协调一致性(phase coherence)。研究表明,SCN通过影响进食行为、荷尔蒙的分泌、神经系统以及体温进一步维持外周节律钟的同步化。然而,外周节律钟如何接收到来自于SCN驱动的同步化信号依然有待于进一步的探索。
该研究发现肝脏中的SIRT7蛋白水平的节律受到光信号的调控,并且不依赖于进食行为。光信号通过SCN驱动了体温(Body temperature,BT)的昼夜节律,进一步影响了热激蛋白HSP70与SIRT7的相互作用,HSP70在体温升高的时候介导了SIRT7蛋白的降解。这表明SIRT7是肝脏中较为早期的接收到SCN信号的蛋白。进一步的研究发现SIRT7可以直接对节律钟的核心蛋白Cryptochrome 1(CRY1)的K565和K579进行去乙酰化,并且促进E3 ligase FBXL3复合物所介导的CRY1的泛素蛋白酶体降解。Sirt7突变小鼠肝脏节律基因的振幅有明显的降低,而且相位发生明显的位移。更重要的是,Sirt7突变小鼠肝脏节律基因能够更快地适应进食所介导的肝脏节律基因的相位移动,这表明肝脏的SIRT7整合了SCN调控的体温信号和肝脏的节律钟。最后对Sirt7突变小鼠的肝脏糖代谢的研究发现,SIRT7特异性地调控了光周期条件下的肝脏糖异生,而Sirt7突变导致光周期条件下血糖的明显降低。该研究揭示了一条新的信号途径BT/HSP70-SIRT7-CRY1介导了中央节律和外周节律的同步化过程。
该研究获得了国家重点研发计划、国家自然科学基金、广东省科技项目和深圳市科创委、发改委的资助。
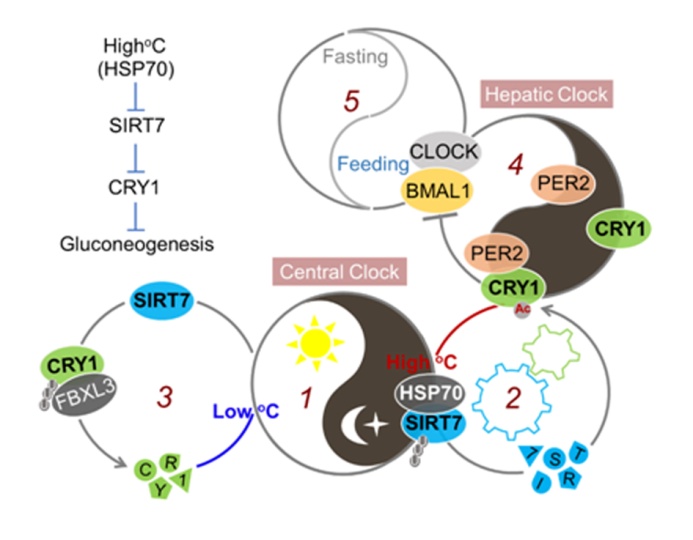
SIRT7 ensures phase coherence between the central and peripheral clocks and maintains glucose homeostasis
原文链接:https://www.nature.com/articles/s42255-019-0136-6


用户登录
还没有账号?
立即注册