深圳大学卡尔森国际肿瘤中心朱卫国团队在Science Advances杂志上揭示组蛋白甲基转移酶SMYD2介导非同源末端连接修复和肿瘤免疫的新机制
DNA损伤修复(DNA damage repair,DDR)是一把双刃剑,在肿瘤易感性和耐药过程中发挥着不同的作用。最近的研究表明,DDR抑制剂影响免疫监视过程。然而,人们对这一现象知之甚少。
近日,同济大学附属第一妇婴保健院陆雯/汤明、深圳大学朱卫国及上海交通大学附属仁济医院肿瘤研究所刘永忠共同通讯在Science Advances 在线发表题为SMYD2 inhibition-mediated hypomethylation of Ku70 contributes to impaired nonhomologous end joining repair and antitumor immunity 的研究论文,该研究探索了DNA损伤时,组蛋白甲基化酶SMYD2被招募到染色质上并甲基化DNA修复蛋白Ku70,导致Ku70/Ku80/DNA-PKcs复合物的募集,进而调节NHEJ修复通路和免疫应答。该论文揭示了SMYD2可能是一个潜在的癌症治疗靶点,其抑制剂或可运用于未来临床应用。
为了研究SMYD2调节DNA损伤修复的过程,作者首先使用两种模型细胞系来监测SMYD2在DNA双链断裂损伤(DSB)修复途径同源重组(HR)或非同源末端连接(NHEJ)中的作用,检测发现敲低SMYD2或其特异抑制剂AZ505会导致持续的DNA损伤和不正确的修复,尤其影响NHEJ修复。进一步的机制研究发现,SMYD2在DNA损伤的反应中,通过与Ku70核心区域相互作用并甲基化修饰Ku70,此甲基化主要发生在Ku70蛋白的赖氨酸K74,K516,K539位点,甲基化修饰的Ku70促进NHEJ修复复合体Ku70/Ku80/DNA-PKcs招募到DNA损伤位点,进而调节NHEJ损伤修复通路。随后,作者利用敲低SMYD2或其抑制剂AZ505,发现细胞质游离DNA的积累能激活cGAS-STING途径及其相关免疫通路。通过免疫功能健全小鼠模型体内验证,作者发现,与免疫缺陷裸鼠模型不同的是,SMYD2缺陷的肿瘤中DNA损伤大量增加进而导致免疫细胞浸润也随之大量增加,如CD8+ T细胞、自然杀伤 (NK) 细胞等。再使用野生型Ku70或3KR突变型Ku70稳定细胞进行了体内实验后,作者发现注射Ku70-3KR细胞后,肿瘤重量和体积明显减小并积累了更高比例的DNA损伤片段和更多浸润的CD8+ T细胞。当联合DNA损伤和SMYD2的特异性抑制剂AZ505共同处理小鼠后发现AZ505使肿瘤对辐射更敏感,因此该联合用药方式可作为肿瘤治疗的联合策略之一。
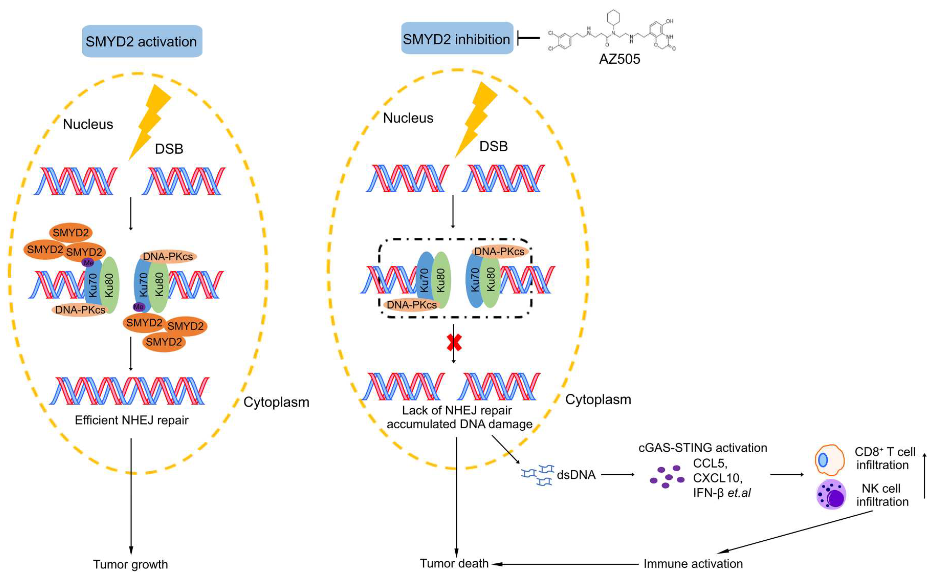
综上所述,此项研究证实了组蛋白甲基转移酶SMYD2通过介导Ku70的甲基化,促进NHEJ修复,SMYD2缺失引起的修复缺陷会导致细胞质断裂DNA的积累,激活cGAS-STING途径,并通过浸润和激活细胞毒性CD8+ T细胞触发抗肿瘤免疫反应。SMYD2的抑制在体内激发了强大的抗肿瘤免疫程序,该效应通过联合放疗进一步增强放疗的敏感性。至此,该研究认为靶向SMYD2可潜在用于开发针对几种主要癌症类型的联合抗肿瘤疗法。
该论文是深圳大学、同济大学、上海交通大学合作的结晶,提升了深圳大学卡尔森国际肿瘤中心在肿瘤研究领域的影响力。
原文链接:https://www.science.org/doi/10.1126/sciadv.ade6624



用户登录
还没有账号?
立即注册