医学部董海峰教授团队在Angew. Chem. Int. Ed.发表原子级精度纳米酶同步破坏线粒体双通路用于精准抗癌研究成果
深圳大学医学部生物医学工程学院董海峰教授在国际知名学术期刊Angewandte Chemie International Edition (影响因子:16.9, 中科院JCR一区, TOP期刊VIP)上发表了题为“Atomic-Precision Triple-Enzyme Nanozyme Synchronizes Mitochondrial Dual-Pathway Disruption for Precision Oncology”的研究论文。医学部生物医学工程学院博士生张玙璠为第一作者,董海峰教授为通讯作者,深圳大学为第一完成单位。

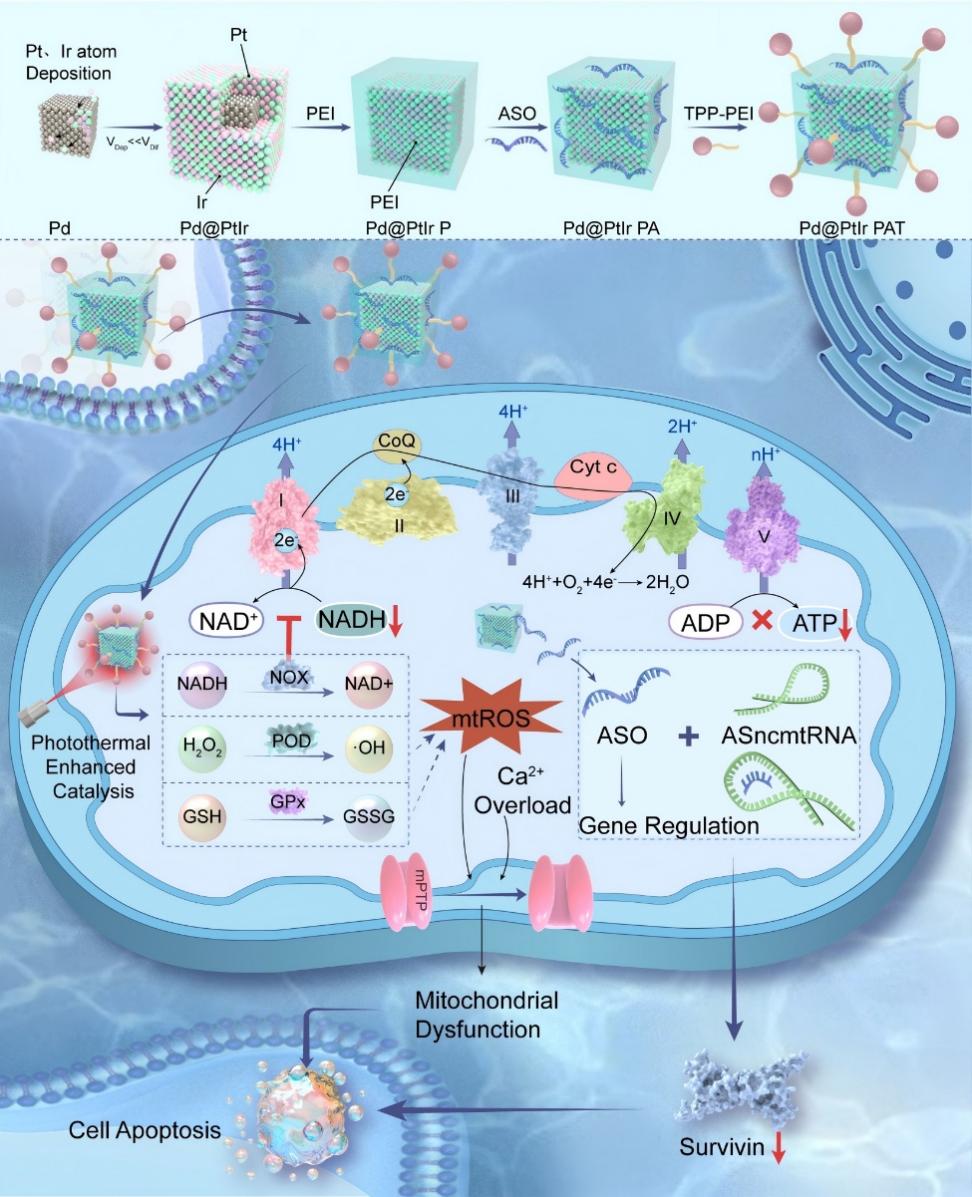
线粒体是细胞的“动力源”,负责产生能量(ATP)、调控细胞凋亡和维持氧化还原平衡。癌细胞为了在体内快速增殖,高度依赖线粒体的氧化磷酸化功能和强大的抗氧化系统。这种“代谢成瘾性”恰恰成为了它们的致命弱点。若能同时破坏线粒体的氧化还原防御系统和能量供应系统,就能对肿瘤细胞造成毁灭性打击。然而,如何在单一纳米平台集成多酶活性并实现精准的时空调控,面临巨大挑战。
本研究以钯(Pd)立方体为核心,通过原子级精度外延沉积铂和铱(Pt/Ir=1:1)合金壳层,开发了一种三苯基膦(TPP)功能化的Pd@PtIr纳米酶。经过合理设计的金属中心结构产生了协同催化界面,不仅增强了过氧化物(POD)酶活性(经密度泛函理论(DFT)验证),还赋予了纳米酶在单一平台内固有的还原型烟酰胺腺嘌呤二核苷酸(NADH)氧化酶(NOX)和谷胱甘肽过氧化物酶(GPx)样功能。在 808 nm近红外(NIR)照射下,纳米酶触发一系列模拟酶的氧化还原反应,共同耗尽肿瘤细胞线粒体中的谷胱甘肽(GSH)并提高活性氧(ROS)水平,同时 NADH 氧化也破坏了 ATP 的生物合成。这些协同作用共同损害了肿瘤细胞线粒体的氧化还原稳态和能量代谢。为了进一步增强治疗效果,我们将纳米酶与反义寡核苷酸(ASO)介导的 ASncmtRNA 沉默相结合,在原位乳腺癌模型中实现了显著的 89.1%的肿瘤消退。这种结合原子精度的催化剂设计、多功能酶活性和基因沉默疗法的综合疗法为肿瘤学中针对细胞器的精准纳米治疗提供了一种变革性的范例。
该研究得到了国家自然科学基金,广东省珠江团队项目, 深圳市医学研究专项资金和深圳市纳米生物传感技术重点实验室等项目的资助。
原文链接: https://onlinelibrary.wiley.com/doi/10.1002/anie.202520859










用户登录
还没有账号?
立即注册