医学部许兴智教授团队揭示DNA复制检验点调控的新机制
近日,医学部许兴智教授团队在《Nucleic Acids Research》(影响因子16.971)在线发表题为“TRIM21 suppresses CHK1 activation by preferentially targeting CLASPIN for K63-linked ubiquitination”的原创研究成果。报道揭示了在多种肿瘤中高表达的E3泛素连接酶TRIM21通过介导CLASPIN的K63-链接形式多聚泛素化修饰来拮抗CLASPIN的K6-链接形式多聚泛素化修饰,从而抑制DNA复制胁迫检验点ATR-CHK1通路激活的新机制。医学部基础医学院博士后朱雪霏为论文第一作者,许兴智教授为通讯作者。
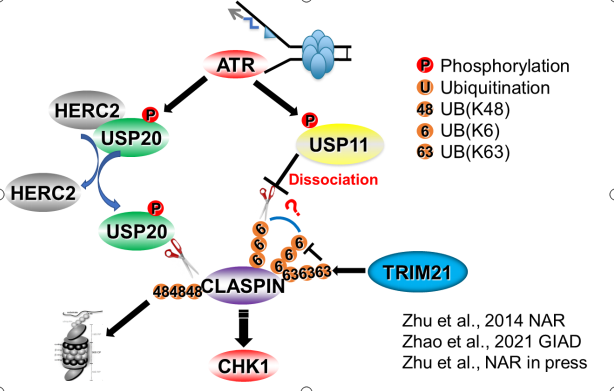
每个细胞周期中,人体细胞需要精准高效地完成多于60亿个DNA碱基的复制。在基因组DNA复制过程中,复制叉会遇到多种类型的DNA畸变并停滞,包括DNA二级结构,重复序列,DNA-RNA杂合链以及DNA损伤等。阻滞的复制叉是极不稳定的结构,容易崩解产生严重危害细胞生命活动的DNA双链断裂。阻滞的复制叉可以有效激活ATR-CHK1信号通路,维持阻滞复制叉的稳定性并激活细胞周期检验点,保证基因组DNA的准确复制和传递。CLASPIN作为介导ATR依赖的CHK1活化的重要衔接蛋白,它通过不同的链接形式的泛素化链进行泛素化修饰,包括 K6、K48 和 K63。众所周知,K48链接形式的泛素化修饰介导被修饰底物的蛋白媒体降解,而乳腺癌易感基因BRCA1介导的K6链接形式的泛素化修饰促进 CLASPIN 染色质加载和随后的 CHK1 激活。许兴智教授研究团队长期关注CLASPIN的泛素化修饰对CHK1活化的协同调控。团队的前期研究揭示了CLASPIN的去泛素化酶USP20(Nucleic Acids Res,2014)和USP11(GIAD,2021)参与调控DNA复制压力应答中CHK1的活化。在DNA复制压力应答中,ATR介导USP20的磷酸化并导致其与E3泛素连接酶HERC2解离,促进USP20的稳定性并对CLASPIN的K48-链接形式多聚泛素化修饰进行去修饰,从而维持CLASPIN蛋白的稳定性并促进CHK1的活化。USP11去泛素化CLASPIN的K6-链接形式多聚泛素化修饰,促进CLASPIN从染色质解离从而抑制CHK1的活化。
最近这项研究鉴定了CLASPIN新的E3泛素连接酶TRIM21。TRIM21介导的CLASPIN的K63-链接形式多聚泛素化修饰,并与其K6-链接形式多聚泛素化修饰相互拮抗。DNA复制压力应答中,TRIM21与CLASPIN相互解离,导致CLASPIN的K63-链接形式多聚泛素化修饰降低,K6-链接形式多聚泛素化修饰升高,促进CLASPIN与TIPIN的相互作用以及CLASPIN在染色质的加载,进而促进CHK1的活化。TRIM21的高表达导致阻滞复制叉稳定性降低,从基因组稳定性方面解释了TRIM21高表达促进肿瘤发生的可能原因。虽然这些研究揭示了CLASPIN泛素化修饰的多种writers和erasers,但是这些writers和erasers如何交互调控CLASPIN的修饰类型和程度及其介导的CHK1活化还有待进一步研究。
该课题组的研究依托深圳大学广东省基因组稳定性与疾病防治重点实验室、卡尔森国际肿瘤中心和马歇尔生物医学工程实验室,获得了国家基金委、广东省重点实验室和深圳市科创委的资助。










用户登录
还没有账号?
立即注册