医学部黄鹏教授团队在《Nature Communications》发表研究论文
近日,深圳大学医学部生物医学工程学院黄鹏特聘教授团队在国际顶级学术期刊《Nature Communications》(影响因子17.694,中科院一区,TOP期刊)上发表了题为《Synthetic biology-instructed transdermal microneedle patch for traceable photodynamic therapy》的研究论文,这是该团队今年在该杂志发表的第三篇研究论文。这篇论文的所有工作均在深圳大学完成,该团队贺港博士研究生为论文第一作者,黄鹏教授为独立通讯作者,深圳大学为唯一单位和唯一通讯单位,该团队所在的生物医学工程学科属于广东省优势重点学科。

基于5-氨基酮戊酸的光动力疗法(5-ALA-PDT)已成为光角化病、基底细胞癌患者等皮肤疾病的主要临床治疗手段,其治疗原理是5-ALA被肿瘤细胞选择性吸收并代谢积累为具有光敏特性的原卟啉IX(PpIX),可在635 nm激光照射下产生单线态氧(1O2)杀伤肿瘤。然而,5-ALA-PDT在实体肿瘤的临床治疗中却面临严峻挑战。一方面,由于缺乏有效的5-ALA递送手段,PpIX的生理合成浓度和滞瘤时间受到血红素合成负反馈机制的限制,导致PpIX积累浓度低,治疗窗口短。实体肿瘤有限的PpIX生物合成浓度和乏氧微环境导致5-ALA-PDT时1O2不足,容易招致更严重的复发和转移。另一方面,在临床实际应用中,5-ALA-PDT的治疗方案缺乏无创的分子影像指导,无法判断瘤内PpIX的最大蓄积浓度的时间点、瘤内的O2浓度,从而指导激光照射参数的设定。基于此,该团队开发了一种由合成生物学指导的诊断微针贴片(MN-CCPCA),由共负载了5-ALA和过氧化氢酶(CAT)的酸响应性降解的铜掺杂磷酸钙纳米粒子(CCPCA NPs)和透明质酸微针组成。MN-CCPCA可通过合成生物学调控手段同时提升肿瘤内PpIX和O2浓度,以增强1O2的产量。此外,利用血红蛋白的高识别光声(PA)吸收和PpIX的荧光(FL)吸收特性,可通过PA/FL联合成像实时监测肿瘤PpIX浓度和血氧饱和度(sO2),确定最佳治疗时间点、治疗持续时间,光照强度、治疗次数以及治疗终点,从而构建效应可测、剂量可调、终点可评估的5-ALA-PDT诊疗体系,实现对不同实体肿瘤的个性化伴随式诊疗(如下图)。
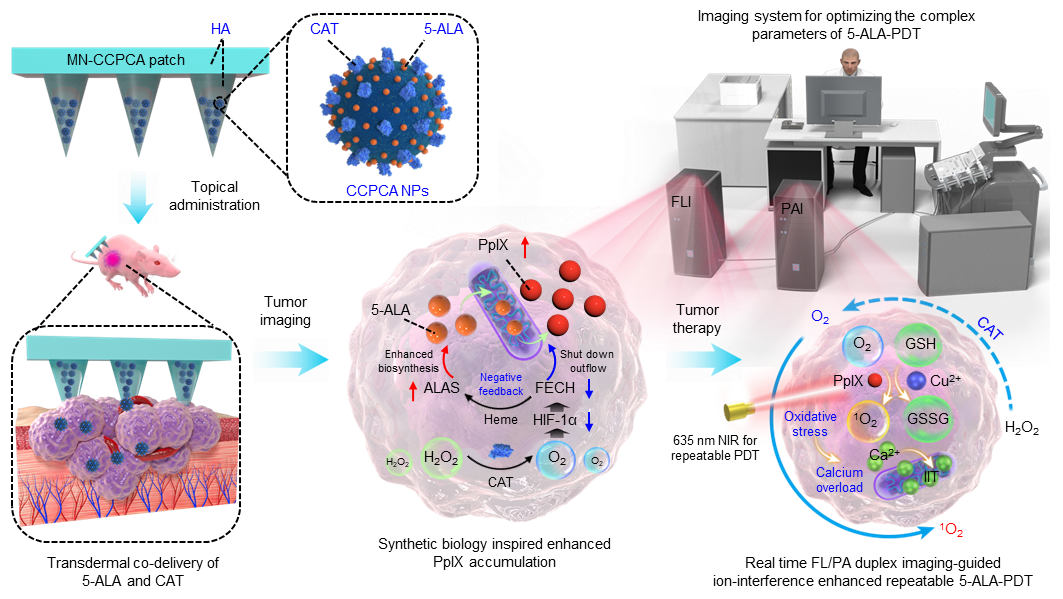
将MN-CCPCA微针局部应用于实体肿瘤后,肿瘤内过表达的透明质酸酶降解微针并释放CCPCA NPs。负载了CAT的CCPCA NPs通过催化肿瘤内过氧化氢(H2O2)持续产生O2,从而诱导乏氧诱导因子-1(HIF-1α)和亚铁螯合酶(FECH)的级联下调,提前阻断CCPCA NPs释放5-ALA诱导的PpIX生物合成短暂升高的负反馈效应,取而代之的是血红素合成减少导致的内源性PpIX生物合成的上调(上调ALA合成酶)。内源性和外源性5-ALA同时转化成PpIX的合成调控可提高瘤内PplX的生理浓度,并延长PpIX的滞瘤时间。5-ALA和CAT生物利用度的提高,进一步放大了sO2的PA信号和PpIX的FL信号,可通过实时的PA/FL双模态成像指导优化5-ALA-PDT在异质实体瘤(乳腺癌、胶质母细胞瘤、黑色素瘤)中的治疗参数。在635 nm激光照射后,PpIX产生大量1O2,CCPCA NPs释放的Cu2+可阻断肿瘤内谷胱甘肽(GSH)对1O2的破坏作用,从而引起严重的氧化应激和Ca2+过载,促进细胞凋亡,实现对5-ALA-PDT疗法的减毒增效。
本研究工作得到了国家重点研发计划、国家自然科学基金、广东省自然科学基金、深圳市科创委等项目的支持。
论文链接:https://www.nature.com/articles/s41467-022-33837-1










用户登录
还没有账号?
立即注册