许兴智教授团队合成并鉴定靶向DNA损伤应答的新型抗癌先导化合物
近日,医学部许兴智教授团队与首都师范大学曹胜利教授团队合作完成的研究成果“A 1,2,3-triazole derivative of quinazoline exhibits antitumor activity by tethering RNF168 to SQSTM1/P62”在药物化学顶级学术期刊《Journal of Medicinal Chemistry》发表。许兴智教授团队博士后王甫城为第一作者,深圳大学为第一署名单位,许兴智教授和曹胜利教授为共同通讯作者。

合适的DNA损伤应答是维持基因组稳定性并防止细胞癌变的根本保障之一,肿瘤的放射治疗和众多的化学治疗药物都是直接或间接靶向DNA损伤应答。蛋白质-蛋白质相互作用(PPI)是所有人体生理和病理过程的基础,靶向PPI是药物开发的有力策略。喹唑啉及其衍生物因其良好的抗肿瘤活性而受到广泛的关注。研究者合成了大量喹唑啉衍生物,如雷替曲塞和吉非替尼等,它们能够通过不同的机制发挥抗肿瘤作用。1,2,3-三氮唑是一种能通过点击反应方便合成的含氮五元杂环,不但能通过氢键、偶极-偶极作用及-堆积等方式与生物靶点结合而作为重要的药效团,还能将不同的药效团连接起来以增强它们的活性。迄今为止,人们已经开发出了大量含1,2,3-三氮唑的抗肿瘤化合物,但鲜有靶向PPI或进入临床研究阶段的报道。
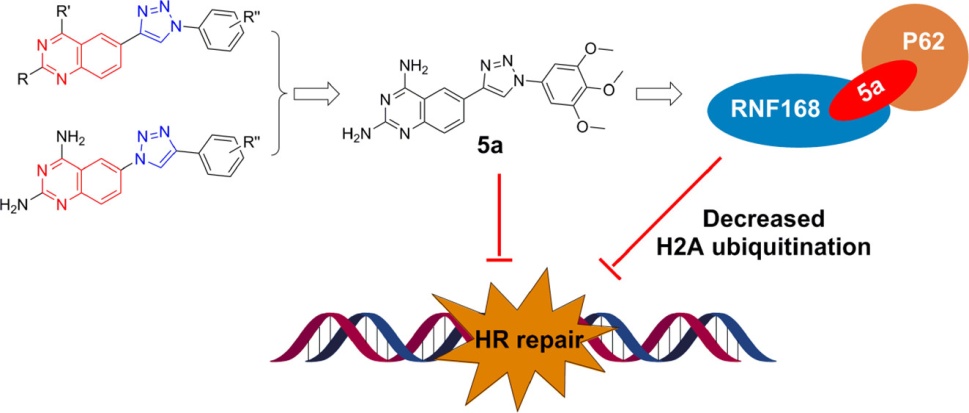
研究团队将含有不同取代基的苯基-1H-1,2,3-三氮唑片段引入喹唑啉骨架的C6位,设计并合成了一系列化合物,从中筛选出抗增殖活性最强的化合物5a。LC-MS/MS质谱分析以及体外和体内结合分析表明,化合物5a能够直接与自噬相关蛋白P62的N端以及E3连接酶RNF168的C端结合,促进两种蛋白在体外和体内的相互作用。RNF168是DNA损伤应答的核心E3连接酶,通过对组蛋白H2A/H2AX进行泛素化而将必需的DNA损伤修复因子招募至DNA双链断裂处,进而完成修复任务;同时,P62蛋白与核内RNF168的结合可以抑制其催化活性。研究团队进一步发现5a处理导致肿瘤细胞的H2A泛素化修饰显著降低并对X-ray辐照的敏感性增加,同时抑制人源肿瘤细胞在小鼠异体移植的生长。由此可见, 5a通过将RNF168与P62绑定在一起而损害DNA修复,从而抑制肿瘤生长。因此,喹唑啉的1,2,3-三氮唑衍生物5a有望通过靶向DNA损伤应答的PPI而成为新型抗癌先导化合物。
该课题组的研究依托深圳大学广东省基因组稳定性与疾病防治重点实验室、卡尔森国际肿瘤中心和马歇尔生物医学工程实验室,获得了国家基金委、广东省重点实验室和深圳市科创委的资助。










用户登录
还没有账号?
立即注册