苏文团队在Nature communications杂志上揭示17β羟基类固醇脱氢酶酶17β-HSD13磷酸化调控肝脂滴水解的新机制
非酒精性脂肪性肝病(NAFLD)在全球发病率高达25%~35%,在我国发病率增加趋势迅速,已成为危害人类健康的重大代谢性疾病。NAFLD包括单纯性脂肪肝和非酒精性脂肪性肝炎(NASH)及相关的肝硬化和肝癌,由于发病的复杂性,目前无FDA批准的NAFLD药物。脂滴的异常蓄积是脂肪肝和多种代谢性疾病的重要病理学特征。团队前期建立了人肝脏脂滴数据库,鉴定到一个新型肝脂滴蛋白17β-HSD13特异性表达于肝脏脂滴表面,其过表达能促进脂肪肝的发生1。该研究于18年被新英格兰杂志和多个专业权威期刊在大规模的人群研究中得到验证,发现其编码基因HSD17B13的SNP与人群中的肝病负相关2。17β-HSD13是17β类固醇脱氢酶家族的成员,在性激素代谢和脂肪酸代谢中起着重要作用。但在Hsh17b13敲除小鼠中并未看到脂肪肝的改善,17β-HSD13的具体功能还有待进一步研究。
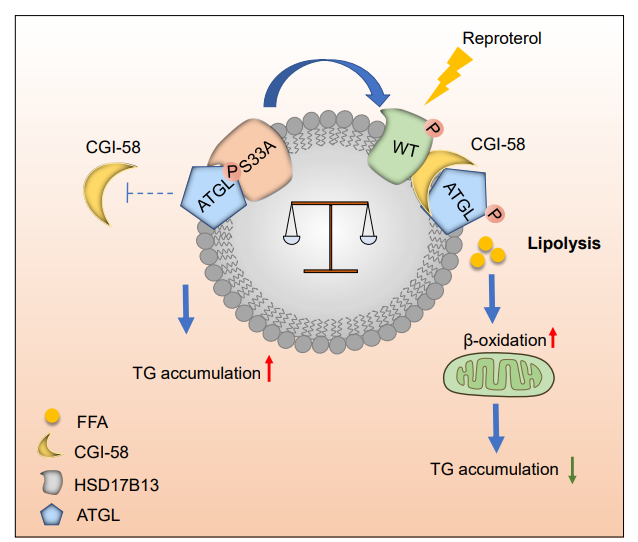
2022年11月3日,深圳大学医学部基础医学院苏文团队联合大连医科大学管又飞教授团队,在Nature communications杂志在线发表了题为Phosphorylation of 17β-hydroxysteroid dehydrogenase 13 at serine 33 attenuates nonalcoholic fatty liver disease in mice的研究论文,首次揭示了17β-HSD13的磷酸化对肝细胞脂滴代谢的重要调控机制。在肝细胞内,PKA信号通路激活后,可以磷酸化17β-HSD13的丝氨酸33位,动态调控17β-HSD13和肝脏重要水解酶ATGL及其辅因子CGI-58三者间的结合,调控脂滴水解和线粒体β-氧化,调控NAFLD的发生。
为了研究17β-HSD13的功能,研究人员首先利用生物信息学方法分析,检测到17β-HSD13在不同物种中存在一个潜在的PKA磷酸化位点,进一步机制研究证实,17β-HSD13是一个新的PKA磷酸化底物,磷酸化质谱技术和体外激酶实验证明17β-HSD13的丝氨酸33位(Ser33)是一个关键的PKA磷酸化位点。随后,作者在细胞上构建了17β-HSD13模拟磷酸化位点失活(S33A)的细胞系,发现17β-HSD13 S33A细胞系相比17β-HSD13 WT的脂滴更大,而脂质合成相关基因并无明显变化。细胞代谢检测发现S33A突变肝细胞系对于PKA信号通路激动剂forskolin响应显著变弱,抵抗水解,同时对于软脂酸诱导的线粒体β-氧化受到抑制,提示脂滴水解功能障碍。
为进一步验证17β-HSD13磷酸化位点的体内功能,研究人员构建了Hsd17b13 Ser33失活点突变knock in(S33A)的小鼠,发现在基础状态下,该小鼠即出现一个显著的脂肪肝表型,同时伴有显著大脂滴的形成。对其肝脏脂滴进行纯化后染色分析发现S33A突变肝脂滴形态有一个明显的向大脂滴漂移倾向。同时S33A小鼠肝脏甘油三酯显著升高,伴随肝酶ALT,AST的加重,血胰岛素水平的增加和血游离脂肪酸的降低。脂质组分析显示多种脂质组分包括甘油三酯、甘油二酯、溶血磷脂胆碱(LPC)、溶血磷脂酰乙醇胺(LPE)显著上调。作者进一步纯化了两组小鼠的脂滴,通过检测脂滴表面的一系列脂滴相关蛋白,发现脂滴水解的重要蛋白甘油三酯水解酶(ATGL)虽然在S33A小鼠中增加,但其辅因子CGI-58在S33A小鼠脂滴显著降低。通过分子动力学模拟、confocal共定位和IP实验,发现17β-HSD13 S33A相比WT和ATGL结合更紧密,竞争性抑制了ATGL和CGI-58的水解。
随后,研究人员用高脂诱导小鼠NAFLD模型,发现S33A小鼠加速了高脂诱导的NASH进程和肝损伤的加重,用腺相关病毒在Hsh17b13敲除小鼠肝内进行高脂诱导后再过表达WT和S33A也得到了同样的结果。原代肝细胞实验发现S33A肝原代相比WT肝原代抵抗foskolin诱导的肝细胞脂滴水解,形成大脂滴,与给ATGL抑制剂表型一致。
最后,研究人员寻找到一个FDA批准的治疗哮喘的药物瑞普特罗(β2受体激动剂),在原代肝细胞实验和体内均确认该药物可以通过激活PKA信号通路磷酸化17β-HSD13 Ser33位点,调控脂滴代谢。在给予NAFLD造模的小鼠瑞普特罗灌胃6周,可以显著抑制NALFD的进展,改善脂肪肝,提示靶向17β-HSD13 Ser33磷酸化是干预NAFLD的潜在药物靶点。
综上所述,此项研究结果证实,17β-HSD13是PKA新的磷酸化底物,并阐明了肝脂滴17β-HSD13丝氨酸33位磷酸化的重要功能,揭示了PKA/17β-HSD13/ATGL信号轴对肝脂滴代谢的调控作用,为靶向17β-HSD13治疗NAFLD及相关代谢疾病提供了进一步的理论基础。
苏文团队长期致力于脂滴蛋白与代谢性疾病调控机制的研究。本次发表的研究是延续其原创发现17β-HSD13的翻译后修饰调控脂滴代谢机制探索。深圳大学医学部苏文副教授为论文第一作者,深圳大学医学部苏文副教授、华东师范大学张晓燕教授和大连医科大学管又飞教授为共同通讯作者。课题组长期招聘糖脂代谢、脂滴-细胞器互作、肿瘤代谢研究方向相关博士后。请感兴趣的有志之士联系suwen@szu.edu.cn。
1.Su, W., et al. Comparative proteomic study reveals 17beta-HSD13 as a pathogenic protein in nonalcoholic fatty liver disease. Proceedings of the National Academy of Sciences of the United States of America 111, 11437-11442 (2014).
2.Abul-Husn, N.S., et al. A Protein-Truncating HSD17B13 Variant and Protection from Chronic Liver Disease. The New England journal of medicine 378, 1096-1106 (2018).










用户登录
还没有账号?
立即注册