医学部生物医学超声团队近期发表系列超声治疗新技术研究成果
在陈思平教授的带领下,医学部生物医学工程学院建有医学超声关键技术国家工程实验室和广东省生物医学信息检测与超声成像重点实验室,主要研究方向为超声换能器、超声治疗、超声成像新方法、高性能彩超关键技术,致力于发展医学超声诊疗前沿技术和产学研合作,近期在超声治疗脑疾病领域发表系列高水平研究论文。
工作一
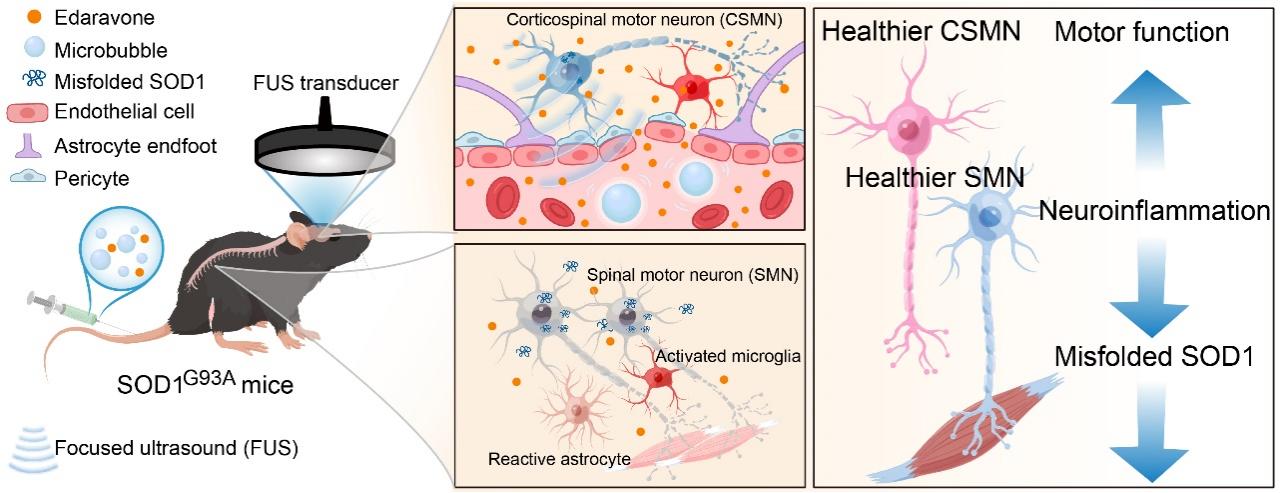
肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis, ALS)是一种致命的快速进行性神经退行性疾病,然而ALS的药物治疗选择非常有限。血脑屏障是脑疾病药物治疗面临的主要瓶颈问题之一,它阻挡了绝大部分药物从血液进入脑组织,从而大大限制了药物的疗效。低强度聚焦超声联合微泡技术是目前唯一能够无创、可逆且局部地开放血脑屏障的物理方法,在中枢神经系统的药物递送方面展现出了巨大的潜力和临床实用价值。该团队日前在《Brain Stimulation》(中科院大类一区TOP期刊,IF: 9.184)发表了题为“Ultrasound–enhanced brain delivery of Edaravone provides additive amelioration on disease progression in an ALS mouse model”的研究论文,首次在国际上报道了采用超声联合微泡技术聚焦至运动皮层可显著提升依达拉奉的递送效率,并在ALS转基因小鼠模型上证明了该方法的积极治疗效果,在超声应用于ALS的临床药物治疗方面迈出了重要的一步。
论文的第一作者为沈圆圆副教授,通讯作者为陈昕教授和杨细飞教授(深圳市疾病预防控制中心);深圳大学为第一完成单位。
原文链接:https://www.brainstimjrnl.com/article/S1935-861X(23)01706-0/fulltext
工作二
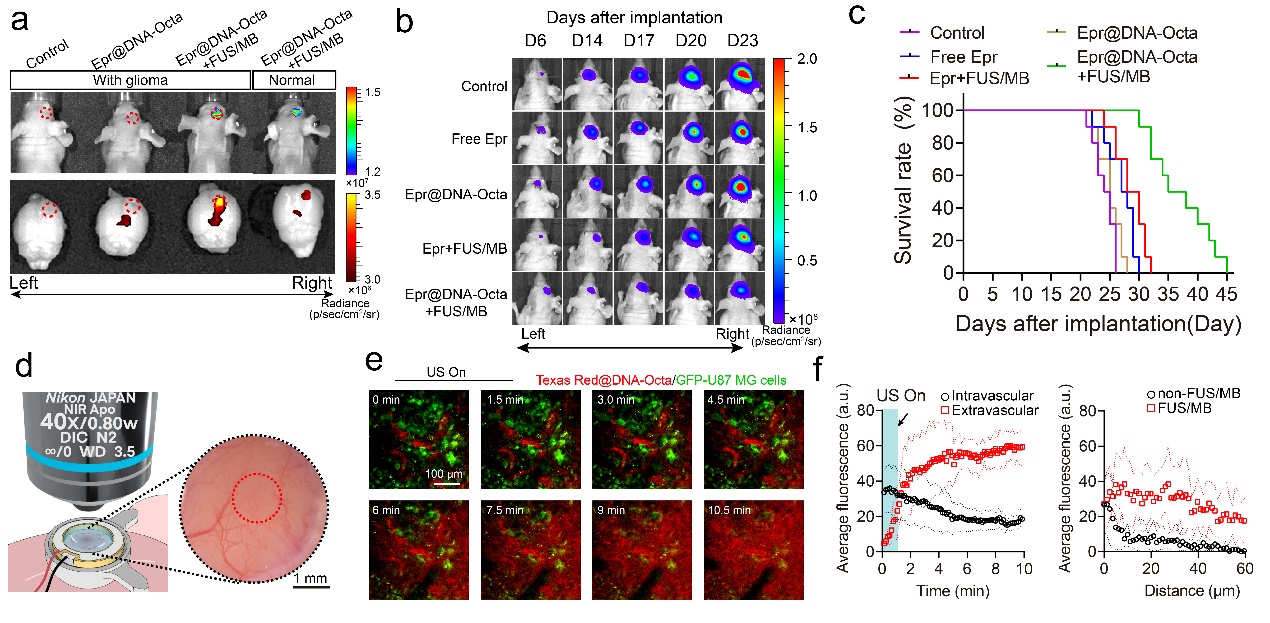
近年来,基于天然生物材料的DNA纳米结构具有良好的生物相容性、设计合成方便灵活、易于修饰、体内稳定性好等优点。然而基于DNA纳米结构的药物治疗脑胶质瘤时同样面临着血脑屏障的问题。该团队与中国药科大学顾月清教授团队合作,在《Journal of Controlled Release》上(中科院大类一区TOP期刊,IF: 11.467)发表题为“Delivery of DNA octahedra enhanced by focused ultrasound with microbubbles for glioma therapy”的论文,报道了低强度聚焦超声联合微泡递送DNA纳米笼药物治疗脑胶质瘤动物模型的治疗作用。
在此项研究中,该团队构建了具有pH响应特性的DNA正八面体纳米结构作为药物载体,搭载抗癌药物表阿霉素。超声联合微泡递送可显著增强递送至脑胶质瘤的DNA纳米笼,并能够在脑胶质瘤酸性环境中释放药物。经过该方法治疗的颅内原位恶性脑胶质瘤裸鼠模型中位生存时间比对照组增加了49%。该研究的亮点是采用双光子荧光活体成像技术,在活体动物身上观察到了超声向脑胶质瘤递送大分子药物的动态实时过程。
论文的第一作者为沈圆圆副教授,通讯作者为陈昕教授和马祎研究员(中国药科大学);深圳大学为第一完成单位。
原文链接:https://www.sciencedirect.com/science/article/pii/S0168365922005247
工作三
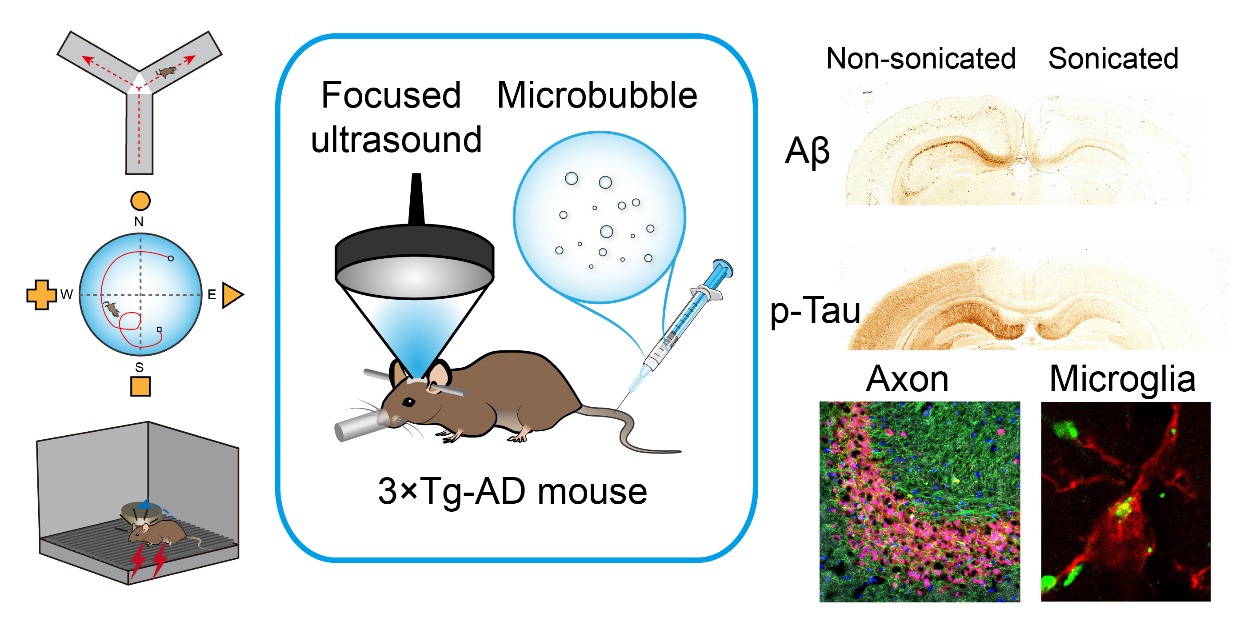
阿尔茨海默症(Alzheimer’s Disease, AD)是进行性发展的致死性神经退行性疾病。发展新型的AD治疗策略具有重要意义。该团队在《Theranostics》(中科院大类一区TOP期刊,IF: 11.556)上发表题为“Ultrasound with microbubbles improves memory, ameliorates pathology and modulates hippocampal proteomic changes in a triple transgenic mouse model of Alzheimer’s Disease”的论文,报道了低强度超声联合微泡无损可逆开放三转基因AD小鼠的血脑屏障,在没有药物的条件下,可对该动物模型产生积极的治疗作用。
在该研究中,对能同时表现出AD两大病理特征(β-淀粉样蛋白沉积和Tau蛋白病变)的3×Tg-AD小鼠进行了每周两次为期六周的低强度超声联合微泡开放其血脑屏障的治疗。行为学测试结果表明经过低强度超声联合微泡治疗的3×Tg-AD小鼠的记忆学习能力与对照组相比得到了显著性的提高。大脑皮层区、海马区和杏仁核区的Aβ沉积和病变Tau蛋白水平显著降低。进一步的研究结果发现治疗后的3×Tg-AD小鼠小胶质细胞被激活并吞噬脑内的Aβ沉积。
论文的第一作者为沈圆圆副教授,通讯作者为陈昕教授和杨细飞教授;深圳大学为第一完成单位。
原文链接:http://www.thno.org/v10p11794.htm
工作四
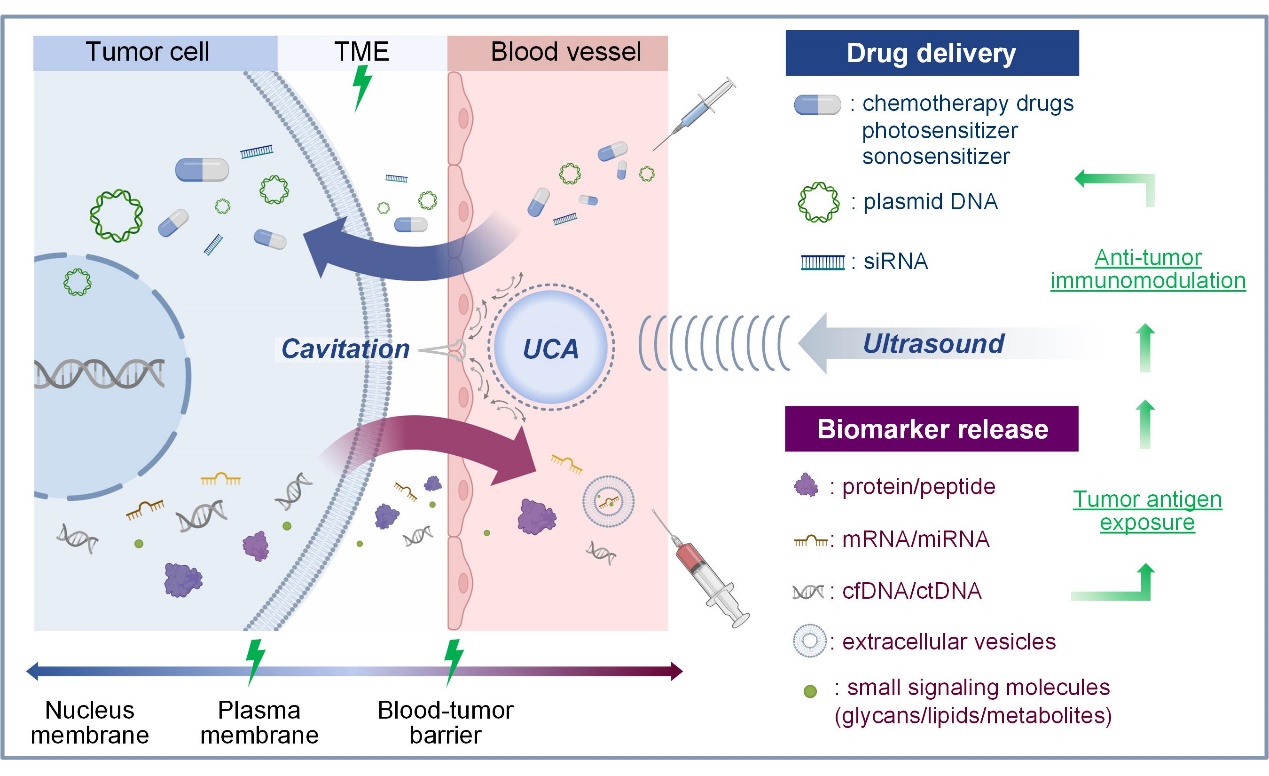
体外施加的超声能量可以无创聚焦于体内肿瘤区域。超声联合微纳声敏剂可以通过空化效应打开肿瘤内多级生物屏障(细胞膜、血管壁和肿瘤微环境),从而创造出向肿瘤内递送药物和向肿瘤外释放标志物的重要双向通道。该团队在声学排名第一的期刊《Ultrasonics Sonochemistry》(中科院大类一区,TOP期刊,IF: 9.336)发表了题为“Barrier-breaking effects of ultrasonic cavitation for drug delivery and biomarker release”的综述论文。论文报道了超声及其微纳造影剂(微泡、纳米液滴和气体稳定纳米颗粒)的多种空化物理科学细节,总结了空化破坏细胞膜屏障的五种效应(膜回缩、声孔、内吞/胞吐、起泡和细胞凋亡),强调了空化作用在介导药物递送和生物标志物释放方面的突破性作用的当前成就,首次建议制定国际空化效应量化标准,用于临床指导空化效应介导的肿瘤屏障精准开放。
论文的第一作者为胡亚欣,第二作者为研究生魏剑鹏,通讯作者为陈昕教授;深圳大学为第一完成单位。
原文链接:https://www.sciencedirect.com/science/article/pii/S1350417723000585










用户登录
还没有账号?
立即注册