医学部黄鹏教授团队在《Advanced Materials》发表研究论文
近日,深圳大学医学部生物医学工程学院黄鹏特聘教授团队在国际顶级学术期刊《Advanced Materials》(影响因子32.086,中科院一区,TOP期刊)上发表了题为《Synchronous Interventions of Glucose and Mitochondrial Metabolisms for Antitumor Bioenergetic Therapy》的研究论文。该团队李萌博士生和罗小明硕士生为论文共同第一作者,黄鹏教授以及林静教授为通讯作者,深圳大学为唯一单位和唯一通讯单位,该团队所在的生物医学工程学科属于广东省优势重点学科。

肿瘤细胞的代谢模式是复杂多变的,它会根据不同的环境选择适合自身生存的最佳代谢模式,具有在糖酵解和氧化磷酸化之间进行切换的能力,如果仅抑制肿瘤细胞的一条代谢途径,另一条能量代谢通路则会被补偿性激活,从而继续满足其快速增殖的能量需求。因此,同时针对两种代谢途径的联合治疗有望提高单一代谢疗法的不足,提高抗癌效力。葡萄糖氧化酶(GOx)可将β-D-葡萄糖催化成葡萄糖酸和过氧化氢(H2O2),从而耗竭肿瘤细胞内的葡萄糖,起到阻断肿瘤细胞糖酵解的目的。目前,GOx与气体疗法的联合得到了越来越多的关注,例如利用GOx和L-精氨酸之间的级联反应,实现了肿瘤饥饿疗法与NO气体的高效协同治疗。然而,上述GOx介导的协同治疗通常会消耗GOx催化生成的H2O2,H2O2在破坏肿瘤细胞氧化还原稳态中发挥着关键作用。此外,气体引起的肿瘤细胞内生物能量的变化还未进行深入研究。基于以上问题,该团队设计并合成了可活化的H2S/H2O2双供体(1-硫代-β-D-葡萄糖[硫代葡萄糖])接枝的功能化聚合物(pGU70TG65),并包载GOx从而制备了粒径均一、稳定性良好的纳米粒(GP)用于肿瘤细胞的葡萄糖和线粒体代谢的同步干预(如下图)。
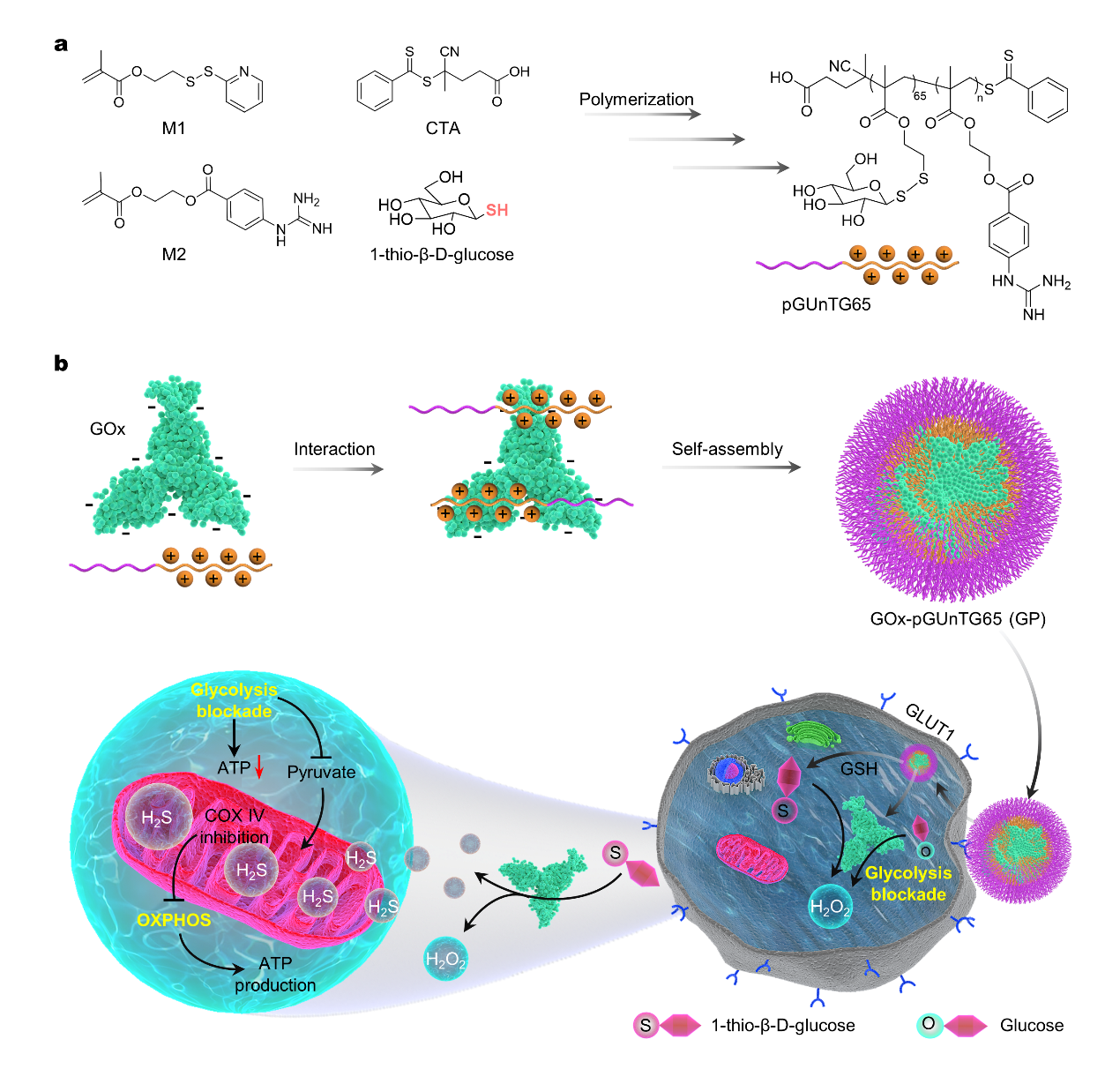
蓄积到肿瘤部位的GP纳米粒可以特异性的靶向肿瘤细胞表面高表达的葡萄糖转运蛋白1,实现天然酶的胞内递送。而摄取进肿瘤细胞内的GP可以特异响应细胞内高浓度的谷胱甘肽释放出硫代葡萄糖,进而激活GOx与硫代葡萄糖之间的催化反应。该催化反应产生的H2S气体可以通过多靶点干预,如抑制细胞色素C氧化酶的表达以及降低线粒体膜电位,引起线粒体的功能障碍。此外,GOx强大的催化活力可以有效地耗竭内源性葡萄糖,从而阻断糖酵解。因此GP可以通过同步干预线粒体与葡萄糖的代谢而打破肿瘤细胞的代谢易变性。
本研究工作得到了国家重点研发计划、国家自然科学基金、广东省基础研究计划、深圳市科技计划等项目的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202301099










用户登录
还没有账号?
立即注册