徐大模/Shau-Ku Huang团队在《Cellular & Molecular Immunology》上合作揭示IL-37a作为核细胞因子调控炎症免疫反应的作用机制
2023年10月27日,深圳大学徐大模/Shau-Ku Huang团队、复旦大学附属儿科医院/生物医学研究院周玉峰团队及中国医学科学院医学实验动物研究所秦川团队在Cellular & Molecular Immunology(IF=24.1)杂志在线发表题为“The nuclear cytokine IL-37a controls lethal cytokine storms primarily via IL-1R8-independent transcriptional upregulation of PPARγ”的研究成果,揭示了IL-37a亚类的生物学特征和功能,特别是可以通过受体IL-1R8依赖和非依赖双重通路, 比IL-37b更有效的抑制致死性细胞因子风暴和内毒素休克。

细胞因子风暴或细胞因子释放综合征是多种炎症、自身免疫性疾病和感染性疾病中常见的致病综合征,包括冠状病毒病2019(COVID-19)和感染性休克。该综合征的特征是促炎性细胞因子如白细胞介素(IL)-1α、IL-1β、IL-6和肿瘤坏死因子(TNF)-α的过量产生,导致系统性炎症、器官衰竭和死亡,目前缺乏有效治疗方法。深入研究人类免疫调节机制,将有助于找到更加安全有效的免疫调节因子和信号分子来治疗细胞因子风暴和炎症性疾病。
IL-37是近年来发现的一种仅在人类,不在小鼠表达的调节性细胞因子,包括5种亚型(IL-37a-e)。然而,IL-37a亚型的具体表达模式和功能,特别是在疾病背景下,尚且未知。
本研究揭示了IL-37a作为新的核细胞因子调控免疫炎症的功能和机制。与其它IL-37亚型不同,IL-37a在其N末端拥有一个NLS序列,通过importin β介导IL-37a进入细胞核,可以结合到PPARγ基因增强子序列促进其转录表达,并通过PPARγ以受体IL-1R8非依赖的形式抑制炎性因子产生。分泌的IL-37a也可以作为细胞因子通过受体IL-1R8依赖的形式发挥其免疫调节功能。这与研究相对较多的另一亚型IL-37b明显不同。该研究为炎症免疫调控以及相关疾病的治疗提供了新思路新方法。
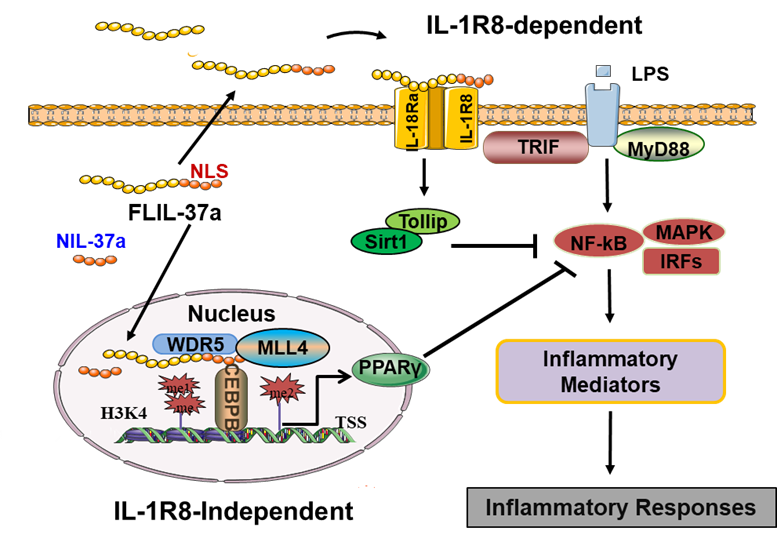
IL-37a双调控炎症反应的工作示意图
深圳大学徐大模/Shau-Ku Huang研究员、复旦大学附属儿科医院/生物医学研究院周玉峰研究员、中国医学科学院医学实验动物研究所秦川教授为论文的共同通讯作者。中国医学科学院医学实验动物研究所/北京协和医学院副研究员韦荣飞和复旦大学附属儿科医院/生物医学研究院副研究员韩晓为论文的共同第一作者。
原文链接:https://www.nature.com/articles/s41423-023-01091-0










用户登录
还没有账号?
立即注册