医学部蔡毅、陈心春教授团队在结核发病机制上取得新进展
结核病是由结核分枝杆菌感染引起的古老传染性疾病,过去由于缺乏有效药物,病死率极高,曾被称为“痨病”“白色瘟疫”。尽管当前已有针对绝大多数敏感菌感染的结核病治疗药物,但由于现今唯一使用的卡介苗对于成人结核缺乏有效保护、耐药结核等问题,结核病仍然是严重危害人类健康的重大传染病。
2023年4月17日,深圳大学医学部陈心春教授团队在国际知名期刊Journal of Clinical Investigation在线发表了题为“Mycobacterium tuberculosis hijacks host TRIM21- and NCOA4-dependent ferritinophagy to enhance intracellular growth”的文章。该研究首次报道结核菌劫持宿主巨噬细胞NCOA4介导的铁蛋白降解(又称铁蛋白自噬),获取营养铁进而促进自身胞内生长,最终增加结核病易感性。本研究有望为结核病精准防治提供新策略。
铁是结核菌及其宿主必需且相互竞争的微量元素。将生物可利用铁固存于巨噬细胞铁蛋白是宿主发挥抗结核免疫的重要机制。然而,结核菌调控宿主铁代谢获取营养铁的机制尚不清楚。该团队发现在低铁环境下,储存于巨噬细胞内的铁蛋白反而有利于胞内结核菌生长。接着,团队证实结核菌感染上调宿主NCOA4,该分子是介导胞内铁蛋白自噬的关键。NCOA4缺失显著抑制胞内游离铁浓度和结核菌生长。在分子机制方面,发现结核菌感染通过p38/AKT1信号通路启动TRIM21蛋白转录,后者作为泛素化E3连接酶介导HERC2降解;HERC2降低,进一步抑制NCOA4蛋白泛素化降解,最终引起NCOA4积累,促进铁蛋白自噬的发生。进一步,团队发现与诊断性切除的结核病肺组织(非进展)相比,因治疗失败切除的结核病肺组织(进展)NCOA4增高,而铁蛋白显著降低,提示NCOA4介导的铁蛋白自噬与临床结核病进展有关。通过构建NCOA4髓系敲除小鼠结核感染模型,发现巨噬细胞NCOA4缺失显著增加小鼠对结核菌感染的抗性,表现为小鼠肺组织细菌载量和病理损伤较低。这些临床数据和小鼠体内结果均证实铁蛋白自噬与结核病发生发展密切相关。
深圳大学医学部陈心春教授,蔡毅副教授为共同通讯作者。课题组博士后代友超博士(现为广州医科大学附属市八医院学科带头人)为本文第一作者。
论文链接:https://doi.org/10.1172/JCI159941
2023年3月15日,悉尼大学Carl G Feng与深圳大学陈心春教授合作在医学TOP杂志Journal of Experimental Medicine发表了题为“Spatial mapping of human lung tissue reveals granuloma diversity and histopathological superstructure in tuberculosis”的研究成果。借助原位单细胞多色荧光染色,以及课题组发展空间单细胞分析算法,通过对组织切片全景分析,首次系统建立了结核肉芽肿的分类和分型。该研究首次建立精准量化不同患者病变的异质性的结核肉芽肿分类分型标准,从而为指导包括严重耐多药结核在内的难治性结核患者开展个体化免疫治疗等精准治疗提供了分型依据;揭示不同肉芽肿形成的动态规律和机制,研究发现CD20 B细胞与CD68 巨噬细胞交互作用,决定着肉芽肿的分型;系统分析肉芽肿在结核免疫保护和免疫病理中的作用及其具体关键决定因素/机制;为建立结核免疫保护评价指标体系,指导新一代有效疫苗研发提供科学依据。深圳大学医学部陈心春特聘教授,悉尼大学冯光达教授为共同通讯作者。
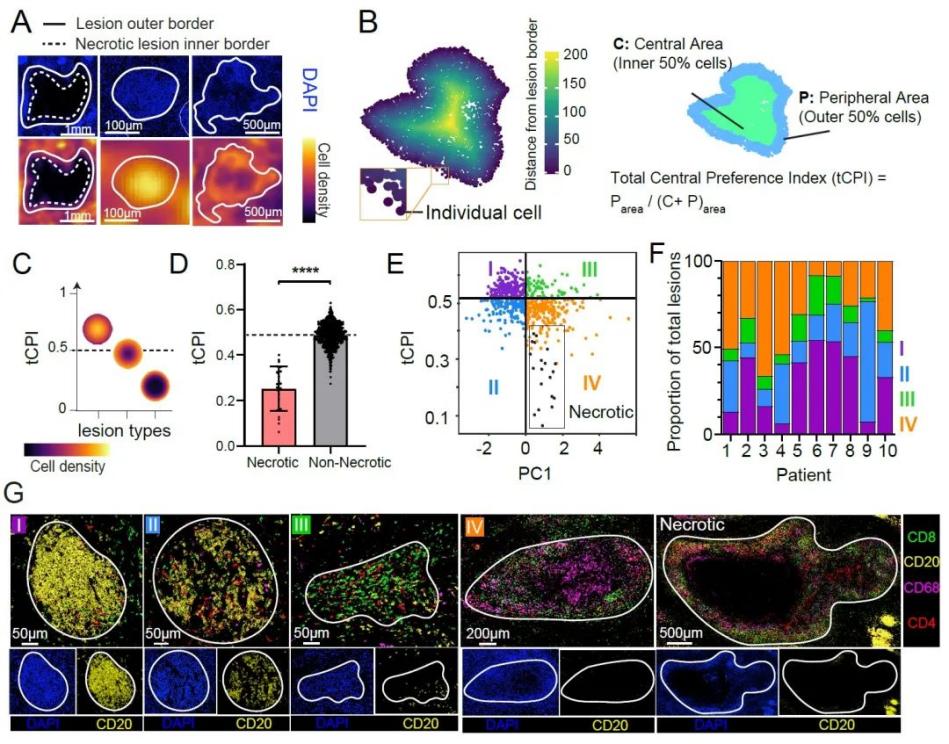
论文链接:https://doi.org/10.1084/jem.20221392
上述研究得到了国家传染病科技重大专项计划、国家自然基金重点项目、青年基金项目,广东省重点实验室和深圳市科创委、发改委等的资助。










用户登录
还没有账号?
立即注册