深圳大学朱卫国教授团队在国际顶级期刊Nature上发表论文揭示DNA损伤应答过程中染色质松散的新机制 取得癌症防治基础研究突破性进展
2025年4月16日,深圳大学医学部基础医学院及卡尔森国际肿瘤中心朱卫国教授团队在《自然》(Nature)杂志在线发表了题为 “Histone H1 deamidation facilitates chromatin relaxation for DNA repair” 的研究论文,揭示了连接组蛋白H1脱酰胺化修饰(deamidation)促进染色质开放和DNA损伤修复的机制,为肿瘤放化疗的精准靶标设计夯实了理论基础,在肿瘤防治基础研究领域取得突破性进展。

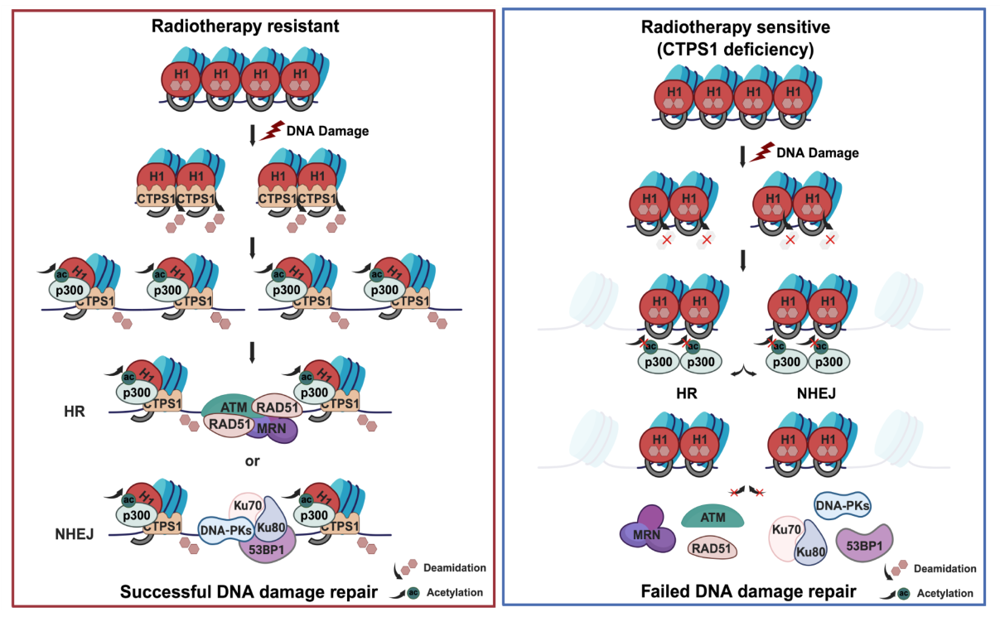
癌症现已成为世界范围内死亡的主要原因之一,中国的癌症新发人数多年来居全球首位。目前癌症的主要疗法包括手术、放疗、靶向药物和其他疗法,但是患者的五年生存率依然不高。癌症治疗的主要瓶颈在于靶向药物的耐药和放疗的抵抗。放疗或某些化疗药物的作用原理都是引起肿瘤细胞DNA双链断裂,从而引起肿瘤细胞死亡;但如果某些肿瘤细胞快速地修复了损伤,肿瘤细胞就可以继续存活,这就会导致肿瘤放疗耐受。放疗耐受是目前肿瘤治疗需要解决的重要瓶颈。因此,如何寻找关键的DNA损伤修复通路和因子,是研究者面临的关键科学问题。目前国内外学者主要关注于DNA损伤后如何修复的机制,但对于早期DNA损伤修复早期如何响应并启动修复却了解很少。DNA损伤修复早期最重要的事件是富含DNA的染色质松散以暴露断裂的DNA与修复因子接触以便进行修复。所以揭示在DNA损伤情况下染色质松散的调控机制有重要的科学意义。
在深圳大学“2035追求卓越研究计划”和医学部“有组织科研行动计划”的大力支持下,朱卫国教授团队二十年来专注于肿瘤表观遗传调控、组蛋白质修饰调控 DNA 损伤应答的研究工作,取得了一系列瞩目的研究成果。近年来团队聚焦于DNA损伤早期的关键事件,经过努力,于4月16日在Nature杂志在线发表研究论文,揭示了连接组蛋白H1脱酰胺化修饰(deamidation)促进染色质开放和DNA损伤修复的机制。
该项研究发现,连接组蛋白H1在DNA双链断裂发生后,其76和77位点的天冬酰胺残基(Asn76与Asn77)发生由CTPS1(胞嘧啶三磷酸合成酶)催化的特异性脱酰胺化,并进而促进邻近75位的赖氨酸残基(Lys75)发生乙酰化。该研究还发现组蛋白乙酰转移酶p300对脱酰胺化后的H1具有显著的底物偏好性,表明脱酰胺修饰促进了后续的乙酰化修饰事件。由于H1的75位赖氨酸是位于连接组蛋白H1的球形结构域内,也是与DNA结合的主要功能域,所以该位点的乙酰化导致了连接组蛋白H1与DNA结合力的减弱,从而引起核小体及染色质的松散并有益于招募DNA损伤修复的关键蛋白到DNA损伤位点修复断裂的DNA。这项研究提示连接组蛋白H1特异位点75位赖氨酸,76和77位的天冬酰胺可能形成一个特异的“开关”控制着染色质的松紧度。该项发现为理解染色质在细胞应激下如何动态变化提供了翔实的数据,也为肿瘤放化疗的精准靶标设计夯实了理论基础。
深圳大学讲席教授、卡尔森肿瘤中心主任朱卫国为本文的通讯作者,深圳大学助理教授田媛、生物学专业2022级在读博士研究生冯婷婷和助理教授张俊为本文的共同第一作者。合作者中除深大师生以外,同济大学上海第一妇婴医院汤明、复旦大学肿瘤医院刘超华、皖南医学院束雨新及北京大学医学部医学遗传系的张羽等也参与了该项研究。
原文链接:https://doi.org/10.1038/s41586-025-08835-0
通讯作者及第一作者介绍
朱卫国,深圳大学讲席教授,博士生导师,深圳大学卡尔森肿瘤中心主任。 历任北京大学校务委员会委员,北京大学基础医学院党委书记,北京大学基础医学院生物化学系主任,“北大-清华生命联合中心”研究员,北京大学 “李大钊奖”获得者。历任深圳大学校务委员会委员,深圳大学医学部主任/医学院院长。曾担任中国抗癌协会肿瘤病因学专业委员会主任委员,中国生物化学与分子生物学会常务理事,中国医学生化学会副主任委员,现任中国生化学会基因转录与调控协会副主任委员,中国细胞学会染色质分会副主任委员,享受国务院特殊津贴。国家重点研发计划“蛋白质机器与生命过程调控”重点专项首席科学家、国家基金委创新群体首席科学家、国家基金委重大及重点项目负责人、国家杰出青年基金获得者、多项国家 “973”计划、“863”计划负责人、国家自然科学基金重大项目医学科学领域专业评审组成员、广东省基因组稳定性与疾病防治重点实验室主任,蛋白质翻译后修饰与细胞功能北京市重点实验室首任主任。担任多种国际杂志编委。主要从事肿瘤表观遗传调控、组蛋白质修饰调控 DNA 损伤应答及细胞自噬的研究工作。主要贡献包括提出了肿瘤表观遗传治疗的作用模式;阐述了部分转录因子的胞浆功能,探明了肿瘤细胞化疗及放疗的DNA损伤应答及修复的部分关键影响因素。以责任作者或第一作者发表学术论文180多篇,包括Nature、Nature Cell Biology、Nature Structural and Molecular Biology, Molecular Cell、PNAS等。 获高等学校自然科技奖一、二等奖(排名第一,2009,2022),中华医学会科技二等奖(排名第一,2011),药明康德生命化学奖(2011), 北京市科学技术奖二等奖(排名第一,2016), 日本癌症学会国际杰出贡献奖(2018),深圳市自然科学奖一等奖(排名第一,2022),连续五年爱思唯尔中国高被引学者(2020,2021,2022,2023,2024)。
田媛,助理教授,2015年于香港中文大学获博士学位,获得香港政府奖学金。毕业后在中科院生物物理研究所任助理研究员-副研究员,2019年加入深圳大学。围绕组蛋白修饰酶在细胞稳态维持方面展开了系统性研究,以第一或通讯作者发表SCI论文8篇,主持国家自然科学基金面上项目和青年项目、深圳市自然科学基金重点项目和优秀青年基金。
冯婷婷,深圳大学2022级生物学专业在读博士研究生。2019年硕士入学深圳大学基础医学专业,并加入朱卫国教授团队研究学习。主要研究组蛋白翻译后修饰在DNA损伤修复中的作用。参与研究课题发表在Molecular Cell、Genome Instability & Disease等期刊。多次获得医学部优秀博士研究生荣誉。在2022年参加的生物化学与分子生物学会举办的罗氏大学研究基金的竞选中获得二等奖。
张俊,2018年获得香港大学博土学位。随后入深圳大学医学部任职专职副研究员,2023年被深圳大学聘为助理教授。主要从事DNA损伤应答与修复机制与功能研究,研究成果先后以第一或通讯作者身份(含共同)在Nature (2025), Nat Struct & Mol Biol (2023), Cell Rep (2024), Cell Death & Differ (2024)和Nucleic Acids Res (2023)等国际权威期刊发表论文20余篇。目前主持国家自然科学基金(面上项目及青年基金)、广东省自然科学基金等7项科研项目。先后获得美国癌症研究学会在训学者奖(Takeda Oncology Scholar-in-Training Award)和香港科学会青年科学家奖(Young Scientist Award)等荣誉。










用户登录
还没有账号?
立即注册