医学部何前军教授团队在纳米气体治疗领域获得重要进展
深圳大学医学部何前军教授带领的“先进纳米药物课题组“首次提出了利用肿瘤微环境作为内源性刺激源进行原位响应性气体释放的新策略,首次实现了选择性抗肿瘤的气体治疗。该课题组发现金属羰基化合物不仅是CO气体的前体药物,还是一类新型的类Fenton试剂,可以在肿瘤的高水平双氧水微环境下通过一种新型类Fenton反应将双氧水原位分解为羟基自由基·OH。强氧化性的·OH接着将强疏水性的金属羰基化合物氧化,从而产生CO气体(如下图所示)。因此,该课题组使用亲水性的空心介孔二氧化硅(hMSN)大量担载疏水性的金属羰基化合物前药(MnCO),构建了一种新型纳米气体药物(MnCO@hMSN),实现了肿瘤内双氧水响应性可控CO气体释放和肿瘤选择性高效气体治疗(如下图所示)。该工作最近发表在Intratumoral H2O2-Triggered Release of CO from Metal Carbonyl-Based Nanomedicine for Efficient CO Therapy, Chemical Communications, 2017, 53, 5557. 金召奎博士为第一作者,何前军教授为通讯作者,深圳大学为第一单位。
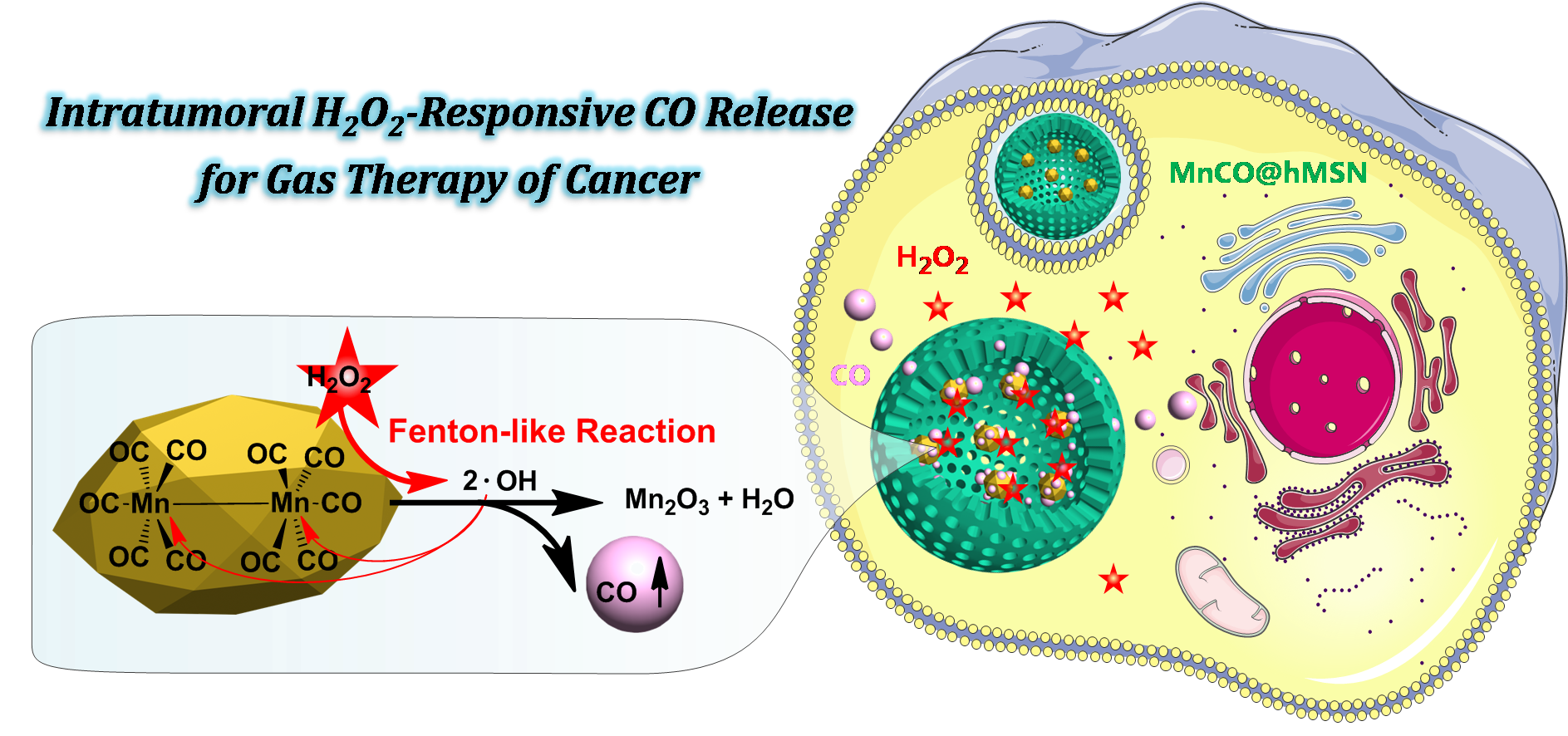
内刺激源可控药物释放具有不受组织穿透深度限制的优势,能够更有效的将药物递送至深层疾病组织,譬如肿瘤内部。针对肿瘤治疗而言,肿瘤微环境是一种理想的内源性刺激源,包括酸性、还原性和高表达的双氧水等。因而,如何借助肿瘤微环境中的内刺激源,来实现内刺激源响应性的气体释放呢?最近,何前军教授最近的一项研究工作为这个科学问题提供了一种解决方案。
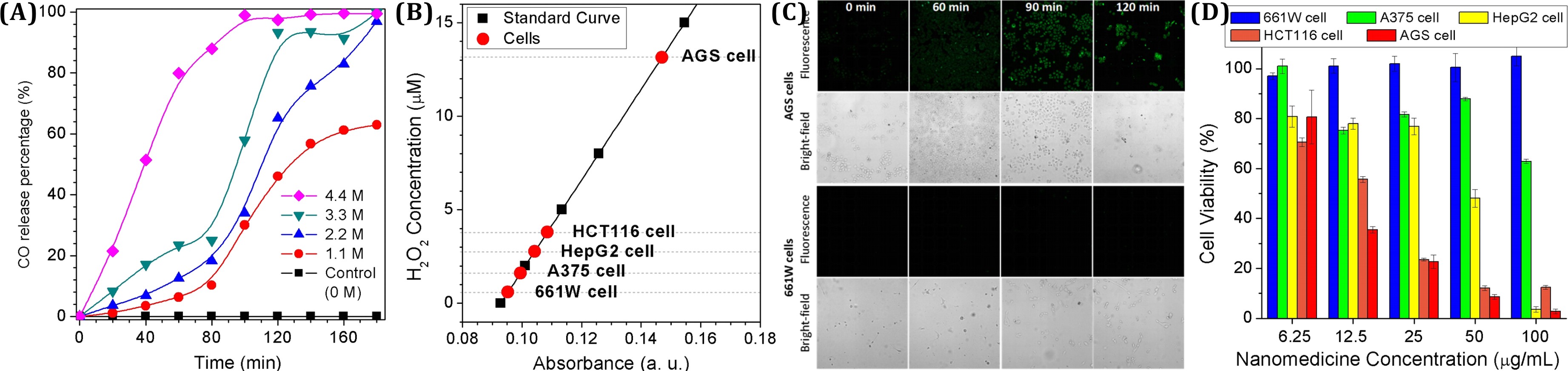
为了实现肿瘤微环境响应性气体释放,该课题组开发了一种新型的对肿瘤内双氧水响应的纳米气体药物MnCO@hMSN(如下图A)。双氧水在正常组织中低表达或者不表达,但在肿瘤中过度表达(如下图B)。这种双氧水表达的巨大差异性导致纳米药物选择性在肿瘤中分解释放CO气体,而在正常组织中不分解释放气体(如下图C),因而产生了一种选择性杀死癌细胞、而对正常细胞没有影响的抗癌特效(如下图D)。该课题组提出的内刺激源响应性控释治疗性气体的策略为选择性抗癌提供了新的思路,有利于极大地提高肿瘤治疗效果、降低药物毒副作用。
《Chemical Communications》是化学领域的国际TOP期刊,属于Nature Index Journals,影响因子6.5,在中科院分区(化学)中为1区期刊。
成果链接: http://pubs.rsc.org/en/Content/ArticleLanding/2017/CC/C7CC01576C










用户登录
还没有账号?
立即注册